Для объяснения происхождения потенциала покоя были предложены различные теории. У истоков современного понимания этой проблемы стоит работа В. Ю. Чаговца, который в 1896 г., будучи студентом-медиком, высказал мысль об ионной природе биоэлектрических процессов и сделал попытку применить теорию электролитической диссоциации Аррениуса для объяснения происхождения этих потенциалов. В дальнейшем в 1902 г. Ю. Бернштейном была развита мембранно-ионная теория, которая модифицирована и экспериментально обоснована А. Ходжкином и А. Хаксли (1952) и в настоящее время пользуется широким признанием. Согласно этой теории, биоэлектрические потенциалы обусловлены неодинаковой концентрацией ионов Кֹ, Naֹ, Сl' внутри и вне клетки и различной проницаемостью для них поверхностной мембраны.
Протоплазма нервных и мышечных клеток содержит в 30—50 раз больше ионов калия, в 8—10 раз меньше ионов натрия и в 50 раз меньше ионов хлора, чём внеклеточная жидкость.
Препятствием для быстрого выравнивания этой разности концентраций является тончайшая (около 100 Å) плазматическая мембрана, покрывающая живые клетки.
 |
Представления о структуре этой мембраны строятся на основании данных, полученных методами электронной микроскопии, оптической микроскопии, диффракции рентгеновых лучей и химического анализа. Предполагают, что мембрана состоит из двойного слоя молекул фосфолипидов, покрытого изнутри слоем белковых молекул, а снаружи слоем молекул сложных углеводов — мукополисахаридов. Трехслойная структура мембраны схематически изображена на рис. 116. Рис. 116. Схема молекулярной структуры мембраны. Показан бимолекулярный липидныи слой Z (кружками обозначены полярные группы фосфолипидов) и два нелипидных монослоя: наружный — мукополисахаридный — Х, внутренний — белковый — Y (по Робертсону). |
В клеточной мембране имеются тончайшие канальцы — «поры» диаметром в несколько ангстрем. Через эти канальцы молекулы воды и других веществ, а такжо ионы, имеющие соответствующий размеру пор диаметр, входят в клетку выходят из нее.
На структурных элементах мембраны фиксируются личные ионы, что придает стенкам ее пор тот или иной заряд и тем самым затрудняет или облегчает прохождение через них ионов. Так, предполагается, что наличие в мембране диссоциированных фосфатных и карбоксильных групп является причиной того, что мембрана нервных волокон значительно менее проницаема для анионов, чем для катионов.
Проницаемость мембраны для различных катионов также неодинакова, и она закономерно изменяется при разных функциональных состояниях ткани. В покое мембрана нервных волокон примерно в 20—100 раз более проницаема для ионов Кֹ, чем для ионов Naֹ, а при возбуждении натриевая проницаемость начинает значительно превышать калиевую проницаемость мембраны.
Для того чтобы понять механизм возникновения мембранного потенциала покоя с точки зрения теории Бернштейна — Ходжкина, рассмотрим модельный опыт. Первую половину сосуда (рис. 117), разделенного искусственной полупроницаемой мембраной, поры которой свободно пропускают положительно заряженные ионы Кֹ и не пропускают отрицательно заряженных ионов SO"4, наполняют концентрированным раствором K2SО4, а левую половину наполняют также раствором K2SО4, но меньшей концентрации.
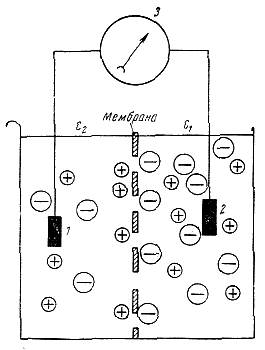 |
Вследствие существования концентрационного градиента ионы Кֹ начнут диффундировать через мембрану преимущественно из правой половины сосуда (где их концентрация равна С1) в левую (с концентрацией С2). Соответственно отрицательно заряженные анионы SO"4, для которых мембрана непроницаема, будут концентрироваться в правой половине сосуда у поверхности мембраны. Своим отрицательным зарядом они электростатически будут удерживать ионы Кֹ на поверхности мембраны слева. В результате мембрана поляризуется: между двумя ее поверхностями возникает разность потенциалов. Рис. 117. Возникновение разности потенциалов на искусственной мембране, разделяющей растворы K2SО4 разной концентрации (С1 и С2). Мембрана избирательно проницаема для катионов Кֹ (маленькие кружки) и не пропускает анионы SО"4 (большие кружки). 1 и 2 — электроды, опущенные в раствор; 3 — электроизмерительный прибор. |
Если теперь в правую и левую половины сосуда опустить электроды, то электроизмерительный прибор обнаружит наличие разности потенциалов, при этом раствор с меньшей концентрацией ионов K2SО4, в который происходит преимущественно диффузия положительно заряженных ионов Кֹ, приобретает положительный заряд по отношению к раствору с большей концентрацией K2SО4.
Разность потенциалов (Е) в рассмотренном случае может быть подсчитана по формуле Нернста:
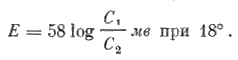
Есть много оснований считать, что сходные отношения имеют место и в живом нервном волокне, поскольку концентрация ионов Кֹ в протоплазме более, чем в 30 роз превышает концентрацию этих ионов в наружном растворе, а органические (белковые и др.) анионы протоплазмы через мембрану практически не проникают.
В состоянии физиологического покоя диффузия положительно заряженных ионов Кֹ из протоплазмы во внешнюю жидкость придает наружной поверхности мембраны положительный заряд, а внутренней — отрицательный.
Важным доводом в пользу правильности этого представления послужил тот факт, что рассчитанная по формуле Нернста разность потенциалов между наружной и внутренней сторона мембраны мышечного волокна (около 90 мв) оказалась близкой к измеренной в опытах с помощью внутриклеточного микроэлектрода.
Было установлено также, что повышение концентрации ионов Кֹ во внешней среде клетки, а следовательно, cнижение разности концентрации этих ионов по обе стороны мембраны приводят к падению потенциала покоя, причем в определенном диапазоне концентрацией эти сдвиги количественно хорошо совпадают с расчитанными по формуле Нернста.
Однако наиболее важные, прямые, доказательства правильности этих представлений были получены А. Ходжкиным с сотрудниками (1962) в опытах с заменой протоплазмы в гигантских нервных волокнах моллюска кальмара солевыми растворами. Из волокна, имеющего диаметр около 1 мл, осторожно выдавливали протоплазму и спавшуюся оболочку заполняли искусственным солевым раствором.
В том случае, когда концентрация ионов калия в этом растворе была близка к внутриклеточной, между внутренней и наружной стороной мембраны устанавливалась разность потенциалов, примерно равная потенциалу покоя нормального волокна (50—80 мв). Уменьшение концентрации ионов Кֹ во внутреннем растворе приводило к закономерному снижению или даже извращению потенциала покоя.
Такие опыты показали, что концентрационный градиент ионов Кֹ действительно является основным фактором, определяющим величину потенциала покоя нервного волокна.
Наряду с ионами Кֹ в возникновении потенциала покоя принимают участие и ионы
Naֹ, диффундирующие в протоплазму из внеклеточной жидкости, где их концентрация
велика. Диффузия эта сильно затруднена низкой натриевой проницаемостью мембраны
в покое. Тем не менее, диффундируя через мембрану внутрь протоплазмы, ионы Naֺ
переносят сюда свои положительные заряды, что несколько уменьшает величину
потенциала покоя, создаваемого диффузией из клетки ионов Кֺ. Этим объясняется
тот факт, что потенциал покоя большинства нервных клеток и волокон имеет
величину не 90 мв, как это следовало ожидать, если бы эхтот потенциал создавался
только ионами Кֺ но 60-70 мв.
Таким образом, величина потенциала
покоя нервных волокон и клеток определяется соотношением числа положительно
заряженных ионов Кֺ, диффундирующих в единицу времени из клетки наружу, и
положительно заряженных ионов Naֺ, диффундирующих через мембрану в
противоположном направлении. Чем это соотношение выше, тем больше величина
потенциала покоя, и наоборот.


